Kamis, 31 Maret 2011
Sabtu, 26 Maret 2011
Biografi Jabir Ibn Hayyan - Bapak Kimia Klasik
 Tokoh besar yang dikenal sebagai “the father of modern chemistry”. Jabir Ibn Hayyan (keturunan Arab, walaupun sebagian orang menyebutnya keturunan Persia), merupakan seorang muslim yang ahli dibidang kimia, farmasi, fisika, filosofi dan astronomi.Jabir Ibn Hayyan (yang hidup di abad ke-7) telah mampu mengubah persepsi tentang berbagai kejadian alam yang pada saat itu dianggap sebagai sesuatu yang tidak dapat diprediksi, menjadi suatu ilmu sains yang dapat dimengerti dan dipelajari oleh manusia.
Tokoh besar yang dikenal sebagai “the father of modern chemistry”. Jabir Ibn Hayyan (keturunan Arab, walaupun sebagian orang menyebutnya keturunan Persia), merupakan seorang muslim yang ahli dibidang kimia, farmasi, fisika, filosofi dan astronomi.Jabir Ibn Hayyan (yang hidup di abad ke-7) telah mampu mengubah persepsi tentang berbagai kejadian alam yang pada saat itu dianggap sebagai sesuatu yang tidak dapat diprediksi, menjadi suatu ilmu sains yang dapat dimengerti dan dipelajari oleh manusia.
Penemuan-penemuannya di bidang kimia telah menjadi landasan dasar untuk berkembangnya ilmu kimia dan tehnik kimia modern saat ini.
Jabir Ibn Hayyan-lah yang menemukan asam klorida, asam nitrat, asam sitrat, asam asetat, tehnik distilasi dan tehnik kristalisasi. Dia juga yang menemukan larutan aqua regia (dengan menggabungkan asam klorida dan asam nitrat) untuk melarutkan emas.
Jabir Ibn Hayyan mampu mengaplikasikan pengetahuannya di bidang kimia kedalam proses pembuatan besi dan logam lainnya, serta pencegahan karat. Dia jugalah yang pertama mengaplikasikan penggunaan mangan dioksida pada pembuatan gelas kaca.
Jabir Ibn Hayyan juga pertama kali mencatat tentang pemanasan wine akan menimbulkan gas yang mudah terbakar. Hal inilah yang kemudian memberikan jalan bagi Al-Razi untuk menemukan etanol.
Jika kita mengetahui kelompok metal dan non-metal dalam penggolongan kelompok senyawa, maka lihatlah apa yang pertamakali dilakukan oleh Jabir. Dia mengajukan tiga kelompok senyawa berikut:
1) “Spirits“ yang menguap ketika dipanaskan, seperti camphor, arsen dan amonium klorida.
2) “Metals” seperti emas, perak, timbal, tembaga dan besi; dan
3) “Stones” yang dapat dikonversi menjadi bentuk serbuk.
Salah satu pernyataannya yang paling terkenal adalah: “The first essential in chemistry, is that you should perform practical work and conduct experiments, for he who performs not practical work nor makes experiments will never attain the least degree of mastery.”
Pada abad pertengahan, penelitian-penelitian Jabir tentang Alchemy diterjemahkan kedalam bahasa Latin, dan menjadi textbook standar untuk para ahli kimia eropa. Beberapa diantaranya adalah Kitab al-Kimya (diterjemahkan oleh Robert of Chester – 1144) dan Kitab al-Sab’een (diterjemahkan oleh Gerard of Cremona – 1187). Beberapa tulisa Jabir juga diterjemahkan oleh Marcelin Berthelot kedalam beberapa buku berjudul: Book of the Kingdom, Book of the Balances dan Book of Eastern Mercury. Beberapa istilah tehnik yang ditemukan dan digunakan oleh Jabir juga telah menjadi bagian dari kosakata ilmiah di dunia internasional, seperti istilah “Alkali”, dsb.
referensi :http://mgmpkimia.wordpress.com
Bioethanol


Sejarah
(Bio)Etanol telah digunakan manusia sejak zaman prasejarah sebagai bahan pemabuk dalam minuman beralkohol. Residu yang ditemukan pada peninggalan keramik yang berumur 9000 tahun dari China bagian utara menunjukkan bahwa minuman beralkohol telah digunakan oleh manusia prasejarah dari masa Neolitik.
Campuran dari (Bio)etanol yang mendekati kemrunian untuk pertama kali ditemukan oleh Kimiawan Muslim yang mengembangkan proses distilasi pada masa Kalifah Abbasid dengan peneliti yang terkenal waktu itu adalah Jabir ibn Hayyan (Geber), Al-Kindi (Alkindus) dan al-Razi (Rhazes). Catatan yang disusun oleh Jabir ibn Hayyan (721-815) menyebutkan bahwa uap dari wine yang mendidih mudah terbakar. Al-Kindi (801-873) dengan tegas menjelaskan tentang proses distilasi wine. Sedangkan (Bio)etanol absolut didapatkan pada tahun 1796 oleh Johann Tobias Lowitz, dengan menggunakan distilasi saringan arang.
Antoine Lavoisier menggambarkan bahwa (Bio)etanol adalah senyawa yang terbentuk dari karbon, hidrogen dan oksigen. Pada tahun 1808 Nicolas-Théodore de Saussure dapat menentukan rumus kimia etanol. Limapuluh tahun kemudian (1858), Archibald Scott Couper menerbitkan rumus bangun etanol. Dengan demikian etanol adalah salah satu senyawa kimia yang pertama kali ditemukan rumus bangunnya. Etanol pertama kali dibuat secara sintetis pada tahu 1829 di Inggris oleh Henry Hennel dan S.G.Serullas di Perancis. Michael Faraday membuat etanol dengan menggunakan hidrasi katalis asam pada etilen pada tahun 1982 yang digunakan pada proses produksi etanol sintetis hingga saat ini.
Pada tahun 1840 etanol menjadi bahan bakar lampu di Amerika Serikat, pada tahun 1880-an Henry Ford membuat mobil quadrycycle dan sejak tahun 1908 mobil Ford model T telah dapat menggunakan (bio)etanol sebagai bahan bakarnya. Namun pada tahun 1920an bahan bakar dari petroleum yang harganya lebih murah telah menjadi dominan menyebabkan etanol kurang mendapatkan perhatian. Akhir-akhir ini, dengan meningkatnya harga minyak bumi, bioetanol kembali mendapatkan perhatian dan telah menjadi alternatif energi yang terus dikembangkan.
Bioetanol, Etanol, Alkohol
Etanol disebut juga etil-alkohol atau alkohol saja, adalah alkohol yang paling sering digunakan dalam kehidupan sehari-hari, hal ini disebabkan karena memang etanol yang digunakan sebagai bahan dasar pada minuman tersebut, bukan metanol, atau grup alkohol lainnya. Sedangkan bioetanol adalah etanol (alkohol yang paling dikenal masyarakat) yang dibuat dengan fermentasi yang membutuhkan faktor biologis untuk prosesnya. Sebenarnya alkohol dalam ilmu kimia memiliki pengertian yang lebih luas lagi. Jadi untuk seterusnya, dalam tulisan ini penggunaan istilah alkohol tidak akan digunakan lagi untuk menghilangkan ambiguitas.
Rumus Kimia
(Bio)Etanol sering ditulis dengan rumus EtOH. Rumus molekul etanol adalah C2H5OH atau rumus empiris C2H6O atau rumus bangunnya CH3-CH2-OH. (Bio)Etanol merupakan bagian dari kelompok metil (CH3-) yang terangkai pada kelompok metilen (-CH2-) dan terangkai dengan kelompok hidroksil (-OH). Secara umum akronim dari (Bio)Etanol adalah EtOH (Ethyl-(OH))
<– Rumus Bangun
(Bio)Etanol(Bio)Etanol tidak berwarna dan tidak berasa tapi memilki bau yang khas. Bahan ini dapat memabukkan jika diminum. Karena sifatnya yang tidak beracun bahan ini banyak dipakai sebagai pelarut dalam dunia farmasi dan industri makanan dan minuman.
Sebagai Bahan Bakar
Saat ini (Bio)Etanol dipakai secara luas di Brazil dan Amerika Serikat. Semua kendaraan bermotor di Brazil, saat ini menggunakan bahan bakar yang mengandung paling sedikit kadar ethanol sebesar 20 %. Pertengahan 1980, lebih dari 90 % dari mobil baru, dirancang untuk memakai (Bio)Etanol murni.
Di Amerika Serikat, lebih dari 1 trilyun mil telah ditempuh oleh kendaraan bermotor yang menggunakan BBM dengan kandungan (Bio)Etanol sebesar 10 % dan kendaraan FFV (Flexible Fuel Vehicle) yang menggunakan BBM dengan kandungan 85 % (Bio)Etanol.
Penggunaan bioetanol sebagai bahan bakar, sebenarnya telah lama dikenal. Seperti telah disebutkan diatas bahwa pada tahun 1880-an Henry Ford membuat mobil quadrycycle dan sejak tahun 1908 mobil Ford model T telah dapat menggunakan (Bio)etanol sebagai bahan bakarnya.. Namun penggunaan bioetanol sebagai bahan bakar nabati kurang ditanggapi pada waktu tersebut, karena keberadaan bahan bakar minyak yang murah dan melimpah. Saat ini pasokan bahan bakar minyak semakin menyusut ditambah lagi dengan harga minyak dunia yang melambung membuat (Bio)Etanol semakin diperhitungkan.
(Bio)Etanol dapat digunakan pada kendaraan bermotor, tanpa mengubah mekanisme kerja mesin jika dicampur dengan bensin dengan kadar (Bio)Etanol lebih dari 99,5%. Perbandingan (Bio)Etanol pada umumnya di Indonesia baru penambahan 10% dari total bahan bakar. Pencampuran (Bio)Etanol absolut sebanyak 10 % dengan bensin (90%), sering disebut Gasohol E-10. Gasohol singkatan dari gasoline (bensin) dan (Bio)Etanol. (Bio)Etanol absolut memiliki angka oktan (ON) 117, sedangkan Premium hanya 87-88. Gasohol E-10 secara proporsional memiliki ON 92 atau setara Pertamax. Pada komposisi ini bioetanol dikenal sebagai octan enhancer (aditif) yang paling ramah lingkungan dan di negara-negara maju telah menggeser penggunaan Tetra Ethyl Lead (TEL) maupun Methyl Tertiary Buthyl Ether (MTBE).
MENGOLAH LIMBAH SAWIT MENJADI BIOETANOL DAN KOMPOS

l. MENGENAL LIMBAH SAWIT
Gundukan limbah sawit meninggi setiap hari. Limbah berupa cangkang, serat, pelepah sawit, dan batang sawit di lahan seluas lapangan bola dan juga mengeluarkan bau tidak sedap. Satu pabrik kelapa sawit dapat menghasilkan 100 ton limbah. Limbah sawit kaya akan selulosa dan hemiselulosa.
Tandan kosong kelapa sawit ,  masing-masing mengandung 45% selulosadan 26% hemiselulosa. Tingginya kadar selulosa pada polisakarida tersebut dapat dihidrolisis menjadi gula sederhana dan selanjutnya difermentasi menjadi etanol. Limbah kelapa sawit jumlahnya sangat melimpah. Pada sebuah pabrik kelapa sawit (PKS) berkapasitas 60 ton tandan/jam dapat menghasilkan limbah 100 ton/hari.
masing-masing mengandung 45% selulosadan 26% hemiselulosa. Tingginya kadar selulosa pada polisakarida tersebut dapat dihidrolisis menjadi gula sederhana dan selanjutnya difermentasi menjadi etanol. Limbah kelapa sawit jumlahnya sangat melimpah. Pada sebuah pabrik kelapa sawit (PKS) berkapasitas 60 ton tandan/jam dapat menghasilkan limbah 100 ton/hari.
ll. BAHAN BAKU PRODUKSI BIOETANOL DAN KOMPOS
Bahan Baku Produksi Bioetanol dan Kompos
-
Bahan Baku Limbah Sawit Menjadi Etanol
Ada beberapa penelitian tentang sawit menjadi etanol, salah satunya Dr Ronny Purwadi (periset Departemen Teknologi Kimia, Institut Teknologi Bandung). Ia telah sukses mengolah limbah kelapa sawit menjadi bioetanol dengan cara mencacah tandan kosong kelapa sawit bersama limbah lain secara manual. Namun saat ini alatnya baru tersedia di Malaysia.
Indonesia kaya dengan matahari dan air sehingga tanaman selulosa mudah tumbuh. Jika didukung dengan penelitian yang memadai produksi bioetanol selulosa efektif untuk dikembangkan.
-
Bahan Baku Limbah Sawit Menjadi Kompos
Selain menjadi bioetanol, tandan kosong kelapa sawit juga dapat diolah menjadi kompos. Tandan kosong kelapa sawit atau TKKS adalah limbah pabrik kelapa sawit yang jumlahnya sangat melimpah. Setiap pengolahan 1 ton TBS (Tandan Buah Segar) akan dihasilkan TKKS sebanyak 22-23 % atau sebanyak 220-230 kg TKKS. Apabila dalam sebuah pabrik dengan kapasitas pengolahan 100 ton/jam dengan waktu operasi selama jam, maka akan dihasilkan sebanyak ton TKKS.

 Jumlah TKKS seluruh Indonesia pada tahun 2004 diperkirakan sebesar 18,2 juta ton. Maka akan sangat sayang jika tidak dimanfaatkan. Sejumlah pabrik kelapa sawit di Indonesia masih membakar TKKS, namun pemerintah saat ini melarang pembakaran TKKS. Sehingga alternatif pengolahan lainnya adalah dengan menimbun (open dumping), dijadikan mulsa di perkebunan kelapa sawit, atau diolah menjadi kompos.
Jumlah TKKS seluruh Indonesia pada tahun 2004 diperkirakan sebesar 18,2 juta ton. Maka akan sangat sayang jika tidak dimanfaatkan. Sejumlah pabrik kelapa sawit di Indonesia masih membakar TKKS, namun pemerintah saat ini melarang pembakaran TKKS. Sehingga alternatif pengolahan lainnya adalah dengan menimbun (open dumping), dijadikan mulsa di perkebunan kelapa sawit, atau diolah menjadi kompos.
Reduce, Produksi bioetanol dari limbah tidak perlu perluasan lahan dan penggunaan pupuk kimia. Selain itu, penggunaan limbah juga membantu mengatasi permasalahan lingkungan seperti polusi air, udara, dan tanah. Produksi kompos dari limbah dapat langsung diaplikasikan ke lapangan. Reuse, Tandan kosong kelapa sawit yang berasal dari limbah kelapa sawit dapat digunakan sebagai bahan baku pembuatan bioetanol.
Bioetanol ini dapat digunakan sebagai bahan bakar yang lebih ramah lingkungan dan dapat diperbaharui dengan cepat (Renewable). TKKS dapat digunakan sebagai bahan pembuat kompos. Dengan demikian tidak perlu membeli lagi pupuk dengan bahan kimia dan dapat menghemat pengeluaran. Serta penggunaan kompos dari bahan TKKS lebih ramah lingkungan pada pengaplikasiannya.
lll. PROSES PEMBUATAN BIOETANOL DAN KOMPOS
Proses Pembuatan Bioetanol dan Kompos
-
Pembuatan Bioetanol dari TKKS
- Limbah kelapa sawit diberikan larutan asam sulfat encer berkonsentrasi 1%-3% sebagai bagian dari tahap hidrolisis. Proses pemanasan dalam hidrolisis terbagi dua yaitu pemisahan lignin dan pemisahan lignoselulosa untuk menghasilkan gula.
- Untuk memecah lignin cacahan kelapa sawit dipanaskan pada suhu 120 MSDUoC – 170 MDSUoC dengan tekanan 4 bar. Proses berlangsung 0,5 – 1 jam menggunakan perebus oktolaf. .Setelah selesai, hidrolisis berpindah ke oktolaf lain. Proses hidrolisis kedua, dengan suhu 240 MSDUoC selama 45 menit. Hasilnya berupa hidrolisat gula terpisah dari kotoran.
- Proses selanjutnya merupakan proses fermentasi dengan menggunakan mikroba Sacharomycetes cereviceae. Fermentasi dalam fermentor pada pH 5 dan suuhu 30 MSDUoC selama 16-24 jam. Pengadukan dan pemanasan harus kontinu agar suhu dan pH stabil. Rendemen yang diperoleh yaitu sekitar 12%. Maka dari 1 ton limbah kelapa sawit dihasilkan 120 liter bioetanol.
-
Pembuatan Kompos dari TKK
- Pencacahan adalah salah satu tahapan penting dalam pengomposan TKKS. Pencacahan ini bertujuan untuk memperkecil ukuran TKKS dan memperluas luas permukaan area TKKS. TKKS yang baru keluar dari pabrik pengolahan langsung dimasukkan ke mesin pencacah. Kapasitas mesin pencacah disesuaikan dengan volume TKKS yang dihasilkan pabrik. Mesin pencacah ini sebaiknya dapat memperkecil ukuran TKKS menjadi ± 5 cm. Mesin dirancang secara khusus yang disesuaikan dengan karakteristik TKKS yang berserat. Selain memperkecil ukuran, pencacahan juga akan mengurangi kadar air TKKS. Sebagian air akan menguap karena luas permukaan TKKS yang meningkat.
- Inokulasi dengan aktivator pengomposan. Aktivator yang digunakan berbahan akitf mikroba dekomposer. Yang berperan aktif dalam mempercepat proses pengomposan. Mikroba yang biasa digunakan yaitu, Fungi pelapuk putih (FPP) dan Trichordema sp. Mikroba ini menghasilkan enzim yang dapat mendegradasi senyawa lignoselulosa secara cepat. Kadar air yang optimal untuk pengomposan berkisar 60%. Kadar air TKKS diupayakan optimal agar proses pengomposan berjalan sempurna. Sehingga mikroba tidak kekurangan air. Apabila kadar air terlalu tinggi maka oksigen yang ada di dalam TKKS hanya sedikit, sehingga proses pengomposan akan berlangsung dalam kondisi anareob inkubasi. TKKS yang telah diinokulasi kemudian ditutup terpal plastik yang cukup tebal, tahan panas dan tahan matahari. Selama proses pengomposan suhu kompos akan meningkat yaitu sekkitar 70oC yang akan berlangsung sekitar 2-3 minggu. Suhu yang tinggi ini menandakan proses dekomposisi sedang berlangsung intensif. Setelah itu suhu akan menurun seperti suhu kompos sebelumnya. Hal ini berarti kompos sudah matang.
- Inkubasi. Proses pengomposan akan berlangsung dalam waktu 1,5-3 bulan. Pengomposan TKKS dengan acticomp berlangsung dalam waktu 1,5bulan. Kompos yang sudah matang segera dipanen. Kompos tersebut diangkut ke lokasi pengemasan atau tempat penampungan sementara kompos, sebelum diaplikasikan ke lapang. Rendemen TKKS ± sebesar 60-65 % dari 1 ton TKKS dapat dihasilkan kompos sebanyak 600-650 kg kompos. Kadar air kompos juga masih cukup kurang lebih 59-60%. Apabila kompos terkena air hujan, kadar air ini bisa lebih tinggi lagi.
IV. PELUANG PEMASARAN PRODUKSI LIMBAH SAWIT
Produk baru yang dapat dihasilkan dari limbah kelapa sawit Tandan Kosong Kelapa Sawit (TKKS) yaitu berupa Bioetanol yang dapat dijadikan sebagai bahan bakar yang ramah lingkungan dan juga sebagai bahan bakar yang renewable yang dpat diatur pembaharuannya sehingga tidak perlu lama menunggu seperti proses pembentukan minyak bumi, dan juga dapat dijadikan sebagai kompos yang lebih ramah lingkungan sehingga tanah yang diaplikasikan pupuk tidak mengeras atau rusak karena ketidakseimbangan unsur haranya akibat penggunaan pupuk kimmia dalam jangka waktu yang lama. Biaya yang diperlukan untuk pembuatan kompos bervariasi, hal ini ditentukan oleh teknologi yang digunakan, biaya tenaga kerja, dan fasilitas yang diperlukan. HPP (Harga Pokok Produksi) Kompos TKKS yang diolah dengan menggunakan ActiComp tidak memerlukan penyiraman dan pembalikan selama proses pembuatan kompos. Peningkatan kualitas kompos tentu saja akan meningkatkan HPP kompos. Peningkatan ini juga tergantung pada teknologi, bahan-bahan, peralatan dan tenaga kerja.Misalkan kompos tersebut dapat dijual dengan harga Rp 350/kg – 400/kg maka selisih keuntungan kotor sebesar Rp 250-350/kg. Dalam satu pabrik yang menghasilkan TKKS sebanyak 60.000 ton/tahun akan dihasilkan kompos sebanyak 3900 ton dengan nilai 13,65 miliar – 15,6.
Biaya yang diperlukan untuk pembuatan kompos bervariasi, hal ini ditentukan oleh teknologi yang digunakan, biaya tenaga kerja, dan fasilitas yang diperlukan. HPP (Harga Pokok Produksi) Kompos TKKS yang diolah dengan menggunakan ActiComp tidak memerlukan penyiraman dan pembalikan selama proses pembuatan kompos. Peningkatan kualitas kompos tentu saja akan meningkatkan HPP kompos. Peningkatan ini juga tergantung pada teknologi, bahan-bahan, peralatan dan tenaga kerja.Misalkan kompos tersebut dapat dijual dengan harga Rp 350/kg – 400/kg maka selisih keuntungan kotor sebesar Rp 250-350/kg. Dalam satu pabrik yang menghasilkan TKKS sebanyak 60.000 ton/tahun akan dihasilkan kompos sebanyak 3900 ton dengan nilai 13,65 miliar – 15,6.
DAFTAR PUSTAKA
http://id.wikipedia.org/wiki/singkong
http://id.shyoong.com/exact-sciences/1860341-mengenal-karakter-umbi/
http://www.iptek.net.id/ind/warintek/?mnu=6&ttg=6&doc=6b29
NATRIUM
(Inggris, soda; Latin, sodanum, obat sakit kepala). Sebelum Davy berhasil mengisolasi unsur ini dengan cara elektrolisis soda kaustik, natrium (unsur ini disebut sodium dalam bahasa Inggris), telah dikenal dalam berbagai suatu senyawa.
Sumber
Natrium banyak ditemukan di bintang-bintang. Garis D pada spektrum matahari sangat jelas. Natrium juga merupakan elemen terbanyak keempat di bumi, terkandung sebanyak 2.6% di kerak bumi. Unsur ini merupakan unsur terbanyak dalam grup logam alkali.
Jaman sekarang ini, sodium dibuat secara komersil melalui elektrolisis fusi basah natrium klorida. Metoda ini lebih murah ketimbang mengelektrolisis natrium hidroksida, seperti yang pernah digunakan beberapa tahun lalu.
Sifat-sifat
Natrium, seperti unsur radioaktif lainnya, tidak pernah ditemukan tersendiri di alam. Natrium adalah logam keperak-perakan yang lembut dan mengapung di atas air. Tergantung pada jumlah oksida dan logam yang terkekspos pada air, natrium dapat terbakar secara spontanitas. Lazimnya unsur ini tidak terbakar pada suhu dibawah 115 derajat Celcius.
Kegunaan
Logam natrium sangat penting dalam fabrikasi senyawa ester dan dalam persiapan senyawa-senyawa organik. Logam ini dapat di gunakan untuk memperbaiki struktur beberapa campuran logam, dan untuk memurnikan logam cair.
Campuran logam natrium dan kalium, NaK, juga merupakan agen heat transfer (transfusi panas) yang penting.
Senyawa-senyawa
Senyawa yang paling banyak ditemukan adalah natrium klorida (garam dapur), tapi juga terkandung di dalam mineral-mineral lainnya seperti soda niter, amphibole, zeolite, dsb.
Senyawa natrium juga penting untuk industri-industri kertas, kaca, sabun, tekstil, minyak, kimia dan logam. Sabun biasanya merupakan garam natrium yang mengandung asam lemak tertentu. Pentingnya garam sebagai nutrisi bagi binatang telah diketahui sejak zaman purbakala.
Di antara banyak senyawa-senyawa natrium yang memiliki kepentingan industrial adalah garam dapur (NaCl), soda abu (Na2CO3), baking soda (NaHCO3), caustic soda (NaOH), Chile salpeter (NaNO3), di- dan tri-natrium fosfat, natrium tiosulfat (hypo, Na2S2O3 . 5H20) and borax (Na2B4O7 . 10H2O).
Isotop-isotop
Ada tiga belas isotop natrium. Kesemuanya tersedia di Los Alamos National Laboratory.
Penanganan
Logam natrium harus ditangani dengan hati-hati. Logam ini tidak dapat diselubungi dalam kondisi inert sehingga kontak dengan air dan bahan-bahan lainnya yang membuat natrium bereaksi harus dihindari.
Sumber
http://periodic.lanl.gov/
Jumat, 25 Maret 2011
ASAM OKSALAT
Tapi tau ga, asam oksalat bersama-sama dengan kalsium dalam tubuh manusia membentuk senyawa yang tak larut dan tak dapat diserap tubuh, dan mencegah penggunaan kalsium yang juga terdapat dalam produk-produk yang mengandung oksalat! Lebih dari itu, asam oksalat dan garamnya yang larut air dapat membahayakan, karena senyawa tersebut bersifat toksis!
Tertarik?
Asam oksalat adalah asam dikarboksilat yang hanya terdiri dari dua atom C pada masing-masing molekul, sehingga dua gugus karboksilat berada berdampingan. Karena letak gugus karboksilat yang berdekatan, asam oksalat mempunyai konstanta dissosiasi yang lebih besar daripada asam-asam organik lain. Besarnya konstanta disosiasi (K1) = 6,24.10-2 dan K2 = 6,1.10-5). Dengan keadaan yang demikian dapat dikatakan asam oksalat lebih kuat daripada senyawa homolognya dengan rantai atom karbon lebih panjang. Namun demikian dalam medium asam kuat (pH <2) proporsi asam oksalat yang terionisasi menurun.
Sifat-sifat umum Asam Oksalat, Asam oksalat dalam keadaan murni berupa senyawa kristal, larut dalam air (8% pada 10o C) dan larut dalam alkohol. Asam oksalat membentuk garam netral dengan logam alkali (NaK), yang larut dalam air (5-25 %), sementara itu dengan logam dari alkali tanah, termasuk Mg atau dengan logam berat, mempunyai kelarutan yang sangat kecil dalam air. Jadi kalsium oksalat secara praktis tidak larut dalam air. Berdasarkan sifat tersebut asam oksalat digunakan untuk menentukan jumlah kalsium. Asam oksalat ini terionisasi dalam media asam kuat. Bahan Makanan yang Mengandung Asam Oksalat Asam oksalat dapat ditemukan dalam bentuk bebas ataupun dalam bentuk garam. Bentuk yang lebih banyak ditemukan adalah bentuk garam. Kedua bentuk asam oksalat tersebut terdapat baik dalam bahan nabati maupun hewani. Jumlah asam oksalat dalam tanaman lebih besar daripada hewan. Diantara tanaman yang digunakan untuk nutrisi manusia dan hewan, atau tanaman yang ditemukan dalam makanan hewan; yang paling banyak mengandung oksalat adalah spesies Spinacia, Beta, Atriplex, Rheum, Rumex, Portulaca, Tetragonia, Amarantus, Musa parasisiaca. Daun teh, daun kelembak dan kakao juga mengandung oksalat cukup banyak. Demikian juga beberapa spesies mushrooms dan jamur (Asperegillus niger, Baletus sulfurous, Mucor, Sclerotinia dan sebagainya.) menghasilkan asam oksalat dalam jumlah banyak (lebih dari 4-5 gram untuk setiap 100 gram berat kering), baik dalam bentuk penanaman terisolasi dan dalam bahan makanan atau makanan ternak dimana jamur tersebut tumbuh.
Distribusi asam oksalat pada bagian-bagian tanaman tidak merata.Bagian daun umumnya lebih banyak mengandung asam oksalat dibandingkan dengan tangkai, sedangkan dalam Poligonaceae, kandungan asam oksalat pada petiole hamper dua kali lebih besar daripada tangkai. Umumnya daun muda mengandung asam oksalat lebih sedikit dibandingkan dengan daun tua. Misalnya pada daun Chenopodiaceae, proporsi asam oksalat dapat bertambah dua kali lipat selama proses penuaan.
Bahan makanan yang mengandung oksalat dapat diklasifikasikan menjadi tiga kelompok, yaitu;
- A. Produk-produk dimana miliequivalen asam oksalat yang terkandung jumlahnya 2-7 kali lebih besar daripada kalsium, seperti bayam, orach, daun beet dan akar beet, sorrel, sorrel kebun, kelembak dan bubuk kakao. Bahan makanan ini tidak hanya menyebabkan kalsium yang terkandung di dalamnya tak dapat dimanfaatkan tetapi dengan besarnya asam oksalat yang terkandung dapat mengendapkan kalsium yang ditambahkan dari produk-produk lain, atau jika tidak ada kalsium yang ditambahkan, dapat berpengaruh toksis.
- B. Pada produk-produk seperti kentang, amaranth, gooseberries, dan currants, asam oksalat dan kalsium terdapat dalam jumlah yang hampir setara (1±0,2), dengan demikian diantara keduanya saling menetralkan/menghapuskan, olah karena itu tidak memberikan kalsium yang tersedia bagi tubuh. Tetapi mereka tidak merngganggu penggunaan kalsium yang diberikan oleh produk lain dan oleh karena itu tidak menimbulkan pengaruh anti mineralisasi seperti pada produk kelompok pertama.
- C. Bahan makanan yang meskipun mengandung asam oksalat dalam jumlah yang cukup banyak, tapi karena pada bahan tersebut kaya akan kalsium, maka bahan makanan tersebut merupakan sumber kalsium. Yang termasuk dalam kelompok ini adalah selada, dandelion, cress, kobis, bunga kol (terutama brokoli), kacang hijau, dan terutam green peas, koherabbi, block raddish, green turnip, dan dalam jumlah sedikit pada semua sayuran dan buah-buahan.
Pengaruh Asam Oksalat terhadap tubuh manusia.
Asam oksalat bersama-sama dengan kalsium dalam tubuh manusia membentuk senyawa yang tak larut dan tak dapat diserap tubuh, hal ini tak hanya mencegah penggunaan kalsium yang juga terdapat dalam produk-produk yang mengandung oksalat, tetapi menurunkan CDU dari kalsium yang diberikan oleh bahan pangan lain. Hal tersebut menekan mineralisasi kerangka dan mengurangi pertambahan berat badan.
Asam oksalat dan garamnya yang larut air dapat membahayakan, karena senyawa tersebut bersifat toksis. Pada dosis 4-5 gram asam oksalat atau kalium oksalat dapat menyebabkan kematian pada orang dewasa, tetapi biasanya jumlah yang menyebabkan pengaruh fatal adalah antara 10 dan 15 gram. Gejala pada pencernaan (pyrosis, abdominal kram, dan muntah-muntah) dengan cepat diikuti kegagalan peredaran darah dan pecahnya pembuluh darah inilah yang dapat menyebabkan kematian.
Mengurangi Konsumsi senyawa Asam Oksalat
Karena pengaruh distropik oleh oksalat tergantung pada ratio molar antara asam oksalat dan kalsium, hal itu dapat dicegah melalui cara, yaitu
- Menghilangkan oksalat dengan membatasi konsumsi bahan makanan yang banyak mengandung oksalat yang larut, yaitu dengan menghindari makan dalam jumlah besar atau juga menghindari makan dalam jumlah kecil tetapi berulang-ulang. Mengkombinasikan beberapa makanan yang banyak mengandung oksalat perlu juga dihindari.
- Dengan cara menaikkan supply kalsium yang akan dapat menetralkan pengaruh dari oksalat.
- Memasak bahan makanan yang mengandung asam oksalat hingga mendidih dan membuang airnya sehingga dapat memperkecil proporsi asam oksalat dalam bahan makanan.
Radiasi Nuklir Ternyata Lebih Ramah dibanding Radiasi Alam
Jika kita berasumsi secara bebas dengan sebuah pertanyaan; jumlah korban mana yang paling banyak diantara jumlah orang yang meninggal karena radiasi nuklir dengan orang yang meninggal karena merokok?. Seandainya anda pakar kesehatan, tentu anda akan menjawab secara meyakinkan bahwa orang yang meninggal karena merokok, lebih banyak jumlahnya. Dan itu fakta. Tetapi dikarenakan media-media informasi seperti TV, surat kabar, ataupun internet, lebih banyak menyuguhkan negatifnya nuklir, sehingga sering mempengaruhi opini publik.
Anda bayangkan saja, jika anda disuguhkan suatu berita tentang peristiwa Hiroshima dan Nagasaki ataupun peristiwa Tragedi Chernobyl yang merengut nyawa ribuan orang sekaligus. Tentu anda akan menyatakan nuklir sangat berbahaya dan berasumsi jumlah korban nukilr lebih banyak karena korbannya secara massal. Hal ini jauh berbeda dengan korban merokok, tentu kita tidak pernah mendengar adanya korban massal akibat keracunan asap rokok. Yang ada korban akibat merokok berjatuhan disekitar kita, yang terkadang tidak kita sadari. Berdasarkan data World Health Organization (WHO) diperkirakan 4,9 juta orang meninggal dunia tiap tahunnya. Umumnya vonis akhir secara kesehatan bagi korban merokok ini adalah karena mengidap penyakit kanker.
Deskripsi diatas adalah salah satu contoh bahwa radiasi alam lebih berbahaya dari radiasi nuklir? kok bisa? Sebenarnya tanpa disadari oleh para perokok, bahwa selama mereka merokok, mereka telah terpapar radiasi salah satu gas radioaktif alam yaitu gas radon yang terdapat dalam daun tembakau. Radioaktif alam ini berasal dari pupuk fospat (P) yang dipupukkan pada daun tembakau sehingga gas radon terakumulasi di dalam tembakau. Sehingga perokok akan mudah terkena kanker paru-paru karena radiasi dari gas radon tersebut dapat masuk ke dalam paru-paru.
Secara umum gas radon ini lebih banyak terserap oleh para penambang bahan galian, karena pekerja tambang secara langsung menghirup gas radon secara berlebihan. Menurut perkiraan resiko kematian akibat gas radon mencapai 0,005%. Di Amerika Serikat misalnya dari sekitar 200 juta penduduknya diperkirakan ada 10-20 ribu orang meninggal karena menghirup gas radon.
Di Indonesia sendiri diketahui beberapa bahan bangunan seperti asbes dan gypsum yang banyak digunakan sebagai atap, semen, dan lain sebagainya mengandung bahan radioaktif. Di Swedia yang beriklim dingin sehingga rumah-rumah dibuat dari tembok yang tebal dengan ventilasi yang sedikit. Karena itu penumpukkan gas radon dalam rumah menjadi berlebih sehingga ada beberapa rumah yang mengandung unsur radiokatif alam seperti U238, Th232, dan K40 di atas batas kewajaran. Kadar gas radon dalam rumah tersebut mencapai 260 Bq/m3 udara, padahal kadar wajar di udara adalah 10 Bq/m3.
Selain radiasi gas radon, beberapa radiasi alam yang lain adalah radiasi kosmik dan sinar UV dari lampu neon. Bila dibandingkan dengan radiasi alam ini, bahaya radiasi nuklir jauh lebih kecil dari radiasi alam yang secara wajar kita terima. Hal ini dikarenakan intensitas kita terpapar oleh radiasi alam hampir setiap hari sedangkan radiasi nuklir hanya terjadi apabila terjadi kebocoran reaktor. Tetapi dengan kemajuan teknologi kemungkinan kebocoran itu sangat kecil karena telah dibuatnya keselamatan reaktor yang berlipat-lipat. Selain itu pula, radiasi nuklir buatan diuntungkan dengan waktu paruh dari sumber radiasi yang singkat, diantaranya Ce137, Co60, Xe, dan I131. Radiasi buatan ini mempunyai waktu paruh yang pendek dan zat radiokatif ini dapat dinyatakan habis jika telah 10 kali waktu paruhnya. Semisal waktu paruh dari I131 adalah 8 hari, jadi apabila terjadi kebocoran reaktor, maka reaksi yodium ini akan habis dalam waktu 80 hari.
Efek Radiasi
Efek radiasi secara umum bagi tubuh manusia dapat dibagi dalam dua kelompok yaitu:
1.
Efek Stokastik
Efek stokastik yaitu efek radiasi yang kemunculannya pada individu tidak bisa dipastikan dengan faktor 10-5 (dari 100.000 orang diperkirakan yang terkena hanya 1 orang). Efek dari radiasi ini dikatakan stokastik jika radiasi yang terserap oleh tubuh dalam dosis rendah yaitu 0,25-1.000 mSv. Misalnya saja pada alat diagnosa gondok, penerimaan radiasi rendah ini diperbolehkan bukan hanya karena aman namun justru menguntungkan.
2.
Efek Deterministik
Efek deterministik yaitu efek radiasi yang pasti muncul bila jaringan tubuh terkena paparan radiasi pengionan. Efek determiristik dapat terjadi bila dosis radiasi yang diterima telah lebih dari ambang batas seharusnya yaitu dibawah 3.000 mSv. Bila radiasi yang diterima diantara 3.000-6.000 mSv maka akan menyebabkan kulit memerah atau kerontokan rambut. 6.000-12.000 mSv akan menyebabkan perasaan mual, nafsu makan berkurang, lesu, lemah, demam, keringat yang berlebihan hingga menyebabkan shock yang beberapa saat akan timbul keluhan yang lebih parah yaitu nyeri perut, rambut rontok, bahkan kematian.
Tetapi kemungkinan efek deterministik ini sangat kecil mengenai kita, dikarenakan berdasarkan survei lembaga penelitian yang menangani nuklir, radiasi nuklir hanya sebesar 0.08 mSv.
Untuk pekerja di reaktor nuklir untuk menangai efek radiasi ini agar tidak sampai ke tubuh individu, terdapat tiga dasar proteksi radiasi (keselamatan radiasi). Yaitu pengaturan waktu kerja dengan radiasi, pengaturan jarak dengan sumber radiasi, dan penggunaan bahan pelindung radiasi. Semakin pendek waktu yang digunakan untuk berada di medan radiasi, semakin jauh dari radiasi dan semakin tebal bahan pelindung, akan memperkecil dosis radiasi yang diterima.
Penutup
Dari penjelasan di atas, dapatlah kita ketahui bahwa nuklir bukanlah momok yang mengerikan bagi kita. Berbagai hal yang kita takutkan ternyata tidak seseram yang dibayangkan. Bahkan dapat dikatakan bahwa teknologi nuklir adalah teknologi ramah lingkungan dan berbagai manfaat dapat kita peroleh dari nuklir ini. Di sini pemerintah dan masyarakat harus mencoba untuk memahami nuklir secara lebih lagi. Karena boleh jadi, perbedaan persepsi dan pertentangan opini tentang pengembangan nuklir di Indonesia, yang selama ini terjadi, boleh jadi dikarenakan karena kita tidak tahu dan terlalu trauma dengan tragedi nuklir masa lalu.
KALIUM
(Inggris, potasium; Latin, kalium, Arab, qali, alkali). Ditemukan oleh Davy pada tahun 1807, yang mendapatkannya dari caustic potash (KOH). Ini logam pertama yang diisolasi melalui elektrolisis. Dalam bahasa Inggris, unsur ini disebut potassium.
Sumber
Logam ini merupakan logam ketujuh paling banyak dan terkandung sebanyak 2.4% (berat) di dalam kerak bumi. Kebanyakan mineral kalium tidak terlarut dalam air dan unsur kalium sangat sulit diambil dari mineral-mineral tersebut.
Mineral-mineral tertentu, seperti sylvite, carnalite, langbeinite, dan polyhalite ditemukan di danau purba dan dasar laut yang membentuk deposit dimana kalium dan garam-garamnya dengan mudah dapat diambil. Kalium ditambang di Jerman, negara bagian-negara bagian New Mexico, California, dan Utah. Deposit besar yang ditemukan pada kedalaman 3000 kaki di Saskatchewan, Kanada diharapkan menjadi tambang penting di tahun-tahun depan.
Kalium juga ditemukan di samudra, tetapi dalam jumlah yang lebih sedikit ketimbang natrium.
Produksi
Kalium tidak ditemukan tersendiri di alam, tetapi diambil melalui proses elektrolisis hidroksida. Metoda panas juga lazim digunakan untuk memproduksi kalium dari senyawa-senyawa kalium dengan CaC2, C, Si, atau Na.

Kegunaan
Permintaan terbanyak untuk kalium adalah untuk pupuk. Kalium merupakan bahan penting untuk pertumbuhan tanaman dan ditemukan di banyak tanah. Campuran logam natrium dan kalium (NaK) digunakan sebagai media perpindahan panas. Banyak garam-garam kalium seperti hidroksida, nitrat, karbonat, klorida, klorat, bromida, ioda, sianida, sulfat, kromat dan dikromat sangat penting untuk banyak kegunaan.
Sifat-sifat
Unsur ini sangat reaktif dan yang paling elektropositif di antara logam-logam. Kecuali litium, kalium juga logam yang sangat ringan. Kalium sangat lunak, dan mudah dipotong dengan pisau dan tampak keperak-perakan pada permukaan barunya. Elemen ini cepat sekali teroksida dengan udara dan harus disimpan dalam kerosene (minyak tanah). Seperti halnya dengan logam-logam lain dalam grup alkali, kalium mendekomposisi air dan menghasilkan gas hidrogen. Unsur ini juga mudah terbakar pada air. Kalium dan garam-garamnya memberikan warna ungu pada lidah api.
Isotop
17 isotop kalium telah diketahui. Kalium normal mengandung 3 isotop, yang satu pada 40 derajat Kelvin (.0118%) merupakan isotop radioaktif dengan paruh waktu 1.28 x 109 tahun.
Penanganan
Radioaktivitas yang ada pada kalium tidak terlalu berbahaya.
UPSTREAM

The business activities of the Pertamina Upstream Directorate cover exploration, production, and transmission of oil and gas. Other activities are Coal Bed Methane (CBM) and geothermal operations. In addition, Pertamina develops an upstream sector research and technology, and also focuses on drilling services in support of these exploration and production activities.
Pertamina's working areas are mostly located in Indonesia, with others overseas. The upstream business of Pertamina is conducted through own operations and through partnerships. Geothermal and CBM exploration and production are entirely carried out in Indonesia, given that there are abundant geothermal and CBM resources in Indonesia with potential for development.
In order to ensure continuity of gas production, Pertamina placed the investment in the CBM business on a firm footing by signing four new Cooperation Contracts (KKS) in the CBM sector, comprising: (1) PHE Metana Kalimantan A managing the Sangatta I Block, East Kalimantan (2) PHE Metana Kalimantan B managing the Sangatta II Block, East Kalimantan; (3) PHE Metana Sumatra Tanjung Enim managing the Tanjung Enim Block, South Sumatra working area; (4) PHE Metana Sumatra 2 managing the Muara Enim Block
Perbandingan Nilai Oktan Bahan Bakar : Kompresi Mesin

pertamina Pernah bingung soal nentuin mau pake Premium ato Pertamax di mobil ato motor yang kamu pake??
Banyak orang yang cuma berfikir pendek, mesin sama2 bisa idup, kl bisa murah kenapa harus mahal. Atau ada juga yang mikir, gw mampu kq beli pertamax, prinsipnya kan makin mahal makin bagus, yaudah gw pake pertamax plus aja skalian.
Pemikiran seperti ini bisa dibilang salah tapi ada benarnya juga. Intinya kenali kebutuhan mesin anda, salah pilih bahan bakar awal dari bencana. Berikut penjelasannya..
Angka oktan menyatakan kandungan molekul iso oktan di bensin. Molekul ini yang menahan terjadinya ngelitik atau detonasi. Sehingga makin tinggi oktan, kuat terhadap kompresi tinggi.
“Kompresi berbanding lurus dengan angka oktan. Kompresi wajib diimbangi oktan tinggi,” jelas Colin Latung, konsultan perminyakan dari URS Indonesia.
Kesesuaian angka oktan dengan kompresi akan memperkecil kemungkinan terjadi gejala nggelitik. “Kalau tetap memaksakan motor dengan kompresi tinggi menggunakan oktan rendah, piston akan jebol. Biaya yang dikeluarkan akan jauh lebih besar,” jelas alumnus Lancaster University, Inggris ini. Artinya, mengubah penggunaan Premium tergantung kompresi motor. Dalam kondisi estede, lihat saja spesifikasi teknis kendaraan yang dibikin pabrikan. Motor 4-tak lokal umumnya punya kompresi kisaran antara 9:1 sampai 9,3:1. Bahkan, motor 4-tak impor seperti Suzuki Satria F150 berkompresi 10,2:1.
“Kalau ingin tidak mengalami detonasi, turunkan kompresi. Ganjal head silinder dengan paking yang lebih tebal,” tambah pria beralamat di Jl. Dr. Kusumaatmaja, Jakarta Selatan.
Konsekuensinya, tenaga motor akan melorot. Menurut Colin, tidak masalah. “Ini untuk penggunaan harian bukan balap,” tambahnya.
Tapi, bagaimana dengan mengoplos aditif octane booster. “Penambahan itu tidak signifikan. Sebab, kandungan kimia octane seperti Metil Cyclo Pentan Dienyl Manganis Tricarbonil (MMT) tidak akan besar mendongkrak angka oktan,” ungkap Colin.
Bagaimana dengan motor 2-tak. Umumnya, perbandingan kompresi lebih rendah. Jadi, pindah pemakaian Pertamax ke Premium nggak masalah. Kebutuhan motor 2-tak terhadap kriteria bahan bakar dianjurkan menggunakan Premium.
Misal, kompresi Kawasaki Ninja-RR 7,2:1. Data Premium beroktan 82-92. “Cukup menyuplai kebutuhan motor berkompresi 7:1-9:1,” jelas Freddyanto Basuki, assistant manager service division, PT Kawasaki Motor Indonesia.
Memang, penggunaan Premium perlu diwaspadai. Soalnya, bahan bakar itu belum bebas timbel (luar Jabotabek).
OKTAN INDONESIA LEBIH RENDAH
Angka oktan bensin yang beredar di Indonesia menurut Colin Latung lebih rendah dibanding dengan sejenis di negara lain. Sebab, kita menganut Research Octane Number (RON). Sedangkan di negara lain, misal, Malaysia menganut Pump Octane Number (POM). “Angka POM didapat dari penjumlahan RON dan MON (Motor Octane Number). Hasilnya dibagi dua,” jelas Colin.
Dengan demikian, kalau angka RON Pertamax dikonversikan ke POM sudah pasti angkanya turun. “Jadi kualitas bahan bakar kita memang tidak baik,”.
Jadi intinya, lihat dulu spesifikasi mesin mobil atau motor yang kamu gunakan. Lihat perbandingan kompresi mesinnya, kl udah tau sesuaikan dengan data berikut.
Pertamax Plus (Oktan 95) = Untuk kompresi mesin dengan perbandingan 10:1 – 11:1
Pertamax (Oktan 92) = Untuk kompresi mesin dengan perbandingan 9:1 – 10:1
Premium (Oktan 82) = Untuk kompresi mesin dengan perbandingan7:1 – 9:1
TIPS :
Jadi udah faham kan? satu lagi tips buat para pengguna kendaraan berkompresi tinggi, kendaraan anda butuh bahan bakar beroktan tinggi, minimal Pertamax tentunya, Pertamax adalah bahan bakar non-Subsidi, jadi harga bakal fluktuatif.
Teliti harga sebelum membeli. Bandingkan dengan produk lain dengan nilai oktan yang sama. seperti Shell, Total, dan Petronas. Ada kalanya harga yang mereka tawarkan lebih murah ketimbang Pertamina. Kl bisa lebih murah, knapa harus bayar mahal??
KATALISATOR MASA DEPAN ( karbene )

Para peneliti di Universitas California Reverside telah sukses menciptakan satu kelas baru dari senyawa karbene yang bersifat sangat reaktif dan dapat digunakan sebagai katalis. Hingga sekarang para kimiawan percaya bahwa senyawa karbene ini yang biasanya disebut sebagai “karbene dengan abnormal N-heterosiklik” atau NHCs sangat tidak mungkin untuk disintesis.
Karbene dibuat dari atom karbon yang tidak umum yang biasanya terikat pada atom logam untuk membentuk kompleks logam-karbene dimana dapat dipakai sebagai katalis yang banyak dibakai di industri farmasi, satu hal lagi yang perlu diketahui adalah bahwa senyawa karbene memiliki sifat yang tidak stabil.
Kompleks logam-karbene dapat dibuat dengan menggunakan dua cara: (a)kompleks dibuat menggunakan satu langkah yaitu tanpa pembuatan karbene terlebih dahulu, dan (b) logam dan senyawa karbene yang telah dibuat terlebih dahulu direaksikan untuk membentuk kompleks logam-karbene.
Pada umumnya jenis logam yang dipakai dalam kompleks logam-karbene adalah rodium, emas, platinum, atau palladium-semua loga ini sangat mahal dan diantaranya bersifat toksik oleh sebab itulah pembuatan senyawa karbene yang dibuat tanpa melibatkan senyawa logam akan tetapi masih bersifat sebagai katalis merupkan salah satu cara untuk menekan biaya pembuatan katalis ini.
Hingga sekaranag, NHCs yang dipakai adalah NHCs yang menggunakan kompleks logam-karbene, dan belum pernah ada yang hanya menggunakan senyawa karbene saja. Para kimiawan berasumsi bahwa NHCs tidak dapat berada dalam bentuk bebasnya, dimana hal ini membuat mereka percaya bahwa NHCs tanpa logam sangat tidak mungkin di buat. Akan tetapi sekarang UC Riverside’s Guy Bertrand, seorang professor kimia telah membalik asumsi tersebut disebabkan dia telah mampu menciptakan NHCs yang bebas logamdan senyawa ini dapat dipakai untuk membuat berbagai macam senyawa kompleks yang lain.
“Berbagai macam spesies kimia dipercaya menjadi tidak stabil disebabkan mereka tidak memenuhi hukum-hukum kestabilan yang telah kita pelajari di sekolah dan akhirnya kepercayaan ini menyebabkan tak seorangpun mencoba untuk membuatnya,” kata Bertrand, yang telah memimpin penelitian ini.
“Bagaimanapun juga tugas seorang peneliti adalah untuk membuka rahasia alam yang kita piker tidak mungkin seperti yang telah kami lakukan untuk membuat NHCs ini dan akhirnya kami pun berhasil”
Senyawa NHCs yang kami ciptakan ini stabil pada suhu ruang baik dalam bentuk padatan maupun larutan, hal ini berarti aplikasi senyawa bebas logam ini sangat luas di dunia industri untuk diaplikasikan pada berbagai macam jenis reaksi baru. Penelitian ini telah dipublikasikan pada “Science 23 Oktober 2009”. Publikasi ini melaporkan bahwa sintesis dan karakteristik senyawa NHCs bebas logam secara keseluruhan akan membuka pandangan baru di dunia katalis kata John Schwab. “aplikasi yang sangat potensial untuk penemuan obat dan proses manufaktur yang nyata disebabkan katalis akan menurunkan biaya produksi dan ramah lingkungan,” katanya lagi.
Betrand sangat tertarik dengan sintesis NHCs yang dapat dibuat secara komersil. “Kami berharap akan banyak kimiawan yang dapat menggunakan karbene ini untuk menemukan berbagai macam aplikasi yang baru,”katanya. Kantor UCR telah mendaftarkan hak paten atas teknologi ini dan sekarang masih mencari partner dari industri yang akan mengembangan teknologi ini secara komersial. Betrand melakukan penelitian ini bersama Eugenia Aldeco-Perez, Amos J. Rosenthal, dan Bruno Donnadieu of UCR; dan Gernot Frenking dan Pattiyil Parameswaran of Phillips-Universitat Marburg, Germany, dan penelitian ini didanai oleh Institut Kesehatan Nasional.
Sumber : chem-is-try.org
Senin, 21 Maret 2011
ZEOLIT
Secara umum, Zeolit memiliki melekular sruktur yang unik, dimana atom silikon dikelilingi oleh 4 atom oksigen sehingga membentuk semacam jaringan dengan pola yang teratur. Di beberapa tempat di jaringan ini, atom Silicon digantikan degan atom Aluminium, yang hanya terkoordinasi dengan 3 atom Oksigen. Atom Aluminium ini hanya memiliki muatan 3+, sedangkan Silicon sendiri memiliki muatan 4+. Keberadaan atom Aluminium ini secara keseluruhan akan menyebababkan Zeolit memiliki muatan negatif. Muatan negatif inilah yang menebabkan Zeolit mampu mengikat kation.
Zeolit juga sering disebut sebagai 'molecular sieve' / 'molecular mesh' (saringan molekuler)karena zeolit memiliki pori-pori berukuran melekuler sehingga mampu memisahkan/menyaring molekul dengan ukuran tertentu.
Zeolit mempunyai beberapa sifat antara lain : mudah melepas air akibat pemanasan, tetapi juga mudah mengikat kembali molekul air dalam udara lembab. Oleh sebab sifatnya tersebut maka zeolit banyak digunakan sebagai bahan pengering. Disamping itu zeolit juga mudah melepas kation dan diganti dengan kation lainnya, misal zeolit melepas natrium dan digantikan dengan mengikat kalsium atau magnesium. Sifat ini pula menyebabkan zeolit dimanfaatkan untuk melunakkan air. Zeolit dengan ukuran rongga tertentu digunakan pula sebagai katalis untuk mengubah alkohol menjadi hidrokarbon sehingga alkohol dapat digunakan sebagai bensin.
Zeolit di alam banyak ditemukan di India, Siprus, Jerman dan Amerika Serikat
Kamis, 03 Maret 2011
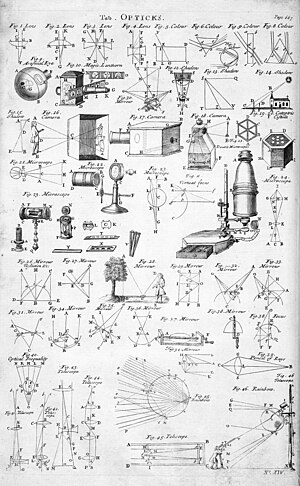
CAHAYA OPTIK
Optika adalah cabang fisika yang menggambarkan perilaku dan sifat cahaya dan interaksi cahaya dengan materi. Optika menerangkan dan diwarnai oleh gejala optis. Kata optik berasal dari bahasa Latin ὀπτική, yang berarti tampilan.
Bidang optika biasanya menggambarkan sifat cahaya tampak, inframerah dan ultraviolet; tetapi karena cahaya adalah gelombang elektromagnetik, gejala yang sama juga terjadi di sinar-X, gelombang mikro, gelombang radio, dan bentuk lain dari radiasi elektromagnetik dan juga gejala serupa seperti pada sorotan partikel muatan (charged beam). Optik secara umum dapat dianggap sebagai bagian dari keelektromagnetan. Beberapa gejala optis bergantung pada sifat kuantum cahaya yang terkait dengan beberapa bidang optika hingga mekanika kuantum. Dalam prakteknya, kebanyakan dari gejala optis dapat dihitung dengan menggunakan sifat elektromagnetik dari cahaya, seperti yang dijelaskan oleh persamaan Maxwell.
Bidang optika memiliki identitas, masyarakat, dan konferensinya sendiri. Aspek keilmuannya sering disebut ilmu optik atau fisika optik. Ilmu optik terapan sering disebut rekayasa optik. Aplikasi dari rekayasa optik yang terkait khusus dengan sistem iluminasi (iluminasi) disebut rekayasa pencahayaan. Setiap disiplin cenderung sedikit berbeda dalam aplikasi, keterampilan teknis, fokus, dan afiliasi profesionalnya. Inovasi lebih baru dalam rekayasa optik sering dikategorikan sebagai fotonika atau optoelektronika. Batas-batas antara bidang ini dan "optik" sering tidak jelas, dan istilah yang digunakan berbeda di berbagai belahan dunia dan dalam berbagai bidang industri.
Karena aplikasi yang luas dari ilmu "cahaya" untuk aplikasi dunia nyata, bidang ilmu optika dan rekayasa optik cenderung sangat lintas disiplin. Ilmu optika merupakan bagian dari berbagai disiplin terkait termasuk elektro, fisika, psikologi, kedokteran (khususnya optalmologi dan optometri), dan lain-lain. Selain itu, penjelasan yang paling lengkap tentang perilaku optis, seperti dijelaskan dalam fisika, tidak selalu rumit untuk kebanyakan masalah, jadi model sederhana dapat digunakan. Model sederhana ini cukup untuk menjelaskan sebagian gejala optis serta mengabaikan perilaku yang tidak relevan dan / atau tidak terdeteksi pada suatu sistem.
Di ruang bebas suatu gelombang berjalan pada kecepatan c = 3×108 meter/detik. Ketika memasuki medium tertentu (dielectric atau nonconducting) gelombang berjalan dengan suatu kecepatan v, yang mana adalah karakteristik dari bahan dan kurang dari besarnya kecepatan cahaya itu sendiri (c). Perbandingan kecepatan cahaya di dalam ruang hampa dengan kecepatan cahaya di medium adalah indeks bias n bahan sebagai berikut : n = c⁄v
Optika klasik
Sebelum optika kuantum menjadi penting, asarnya terdiri dari aplikasi elektromagnetik klasik dan pendekatan frekuensi tinggi untuk cahaya. Optik klasik terbagi menjadi dua cabang utama: optika geometris dan optika fisis.
Optika geometris, atau optika sinar, menjelaskan propagasi cahaya dalam bentuk "sinar". Sinar dibelokkan di antarmuka antara dua medium yang berbeda, dan dapat berbentuk kurva di dalam medium yang mana indeks-refraksinya merupakan fungsi dari posisi. "Sinar" dalam optik geometris merupakan objek abstrak, atau "instrumen", yang sejajar dengan muka gelombang dari gelombang optis sebenarnya. Optik geometris menyediakan aturan untuk penyebaran sinar ini melalui sistem optis, yang menunjukkan bagaimana sebenarnya muka gelombang akan menyebar. Ini adalah penyederhanaan optik yang signifikan, dan gagal untuk memperhitungkan banyak efek optis penting seperti difraksi dan polarisasi. Namun hal ini merupakan pendekatan yang baik, jika panjang gelombang cahaya tersebut sangat kecil dibandingkan dengan ukuran struktur yang berinteraksi dengannya. Optik geometris dapat digunakan untuk menjelaskan aspek geometris dari penggambaran cahaya (imaging), termasuk aberasi optis.
Optika geometris sering disederhanakan lebih lanjut oleh pendekatan paraksial, atau "pendekatan sudut kecil." Perilaku matematika yang kemudian menjadi linear, memungkinkan komponen dan sistem optis dijelaskan dalam bentuk matrik sederhana. Ini mengarah kepada teknik optik Gauss dan penelusuran sinar paraksial, yang digunakan untui order pertama dari sistem optis, misalnya memperkirakan posisi dan magnifikasi dari gambar dan objek. Propagasi sorotan Gauss merupakan perluasan dari optik paraksial yang menyediakan model lebih akurat dari radiasi koheren seperti sorotan laser. Walaupun masih menggunakan pendekatan paraksial, teknik ini memperhitungkan difraksi, dan memungkinkan perhitungan pembesaran sinar laser yang sebanding dengan jarak, serta ukuran minimum sorotan yang dapat terfokus. Propagasi sorotan Gauss menjembatani kesenjangan antara optik geometris dan fisik.
Optika fisis atau optika gelombang membentuk prinsip Huygens dan memodelkan propagasi dari muka gelombang kompleks melalui sistem optis, termasuk amplitudo dan fasa dari gelombang. Teknik ini, yang biasanya diterapkan secara numerik pada komputer, dapat menghitung efek difraksi, interferensi, polarisasi, serta efek kompleks lain. Akan tetapi pada umumnya aproksimasi masih digunakan, sehingga tidak secara lengkap memodelkan teori gelombang elektromagnetik dari propagasi cahaya. Model lengkap tersebut jauh lebih menuntut komputasi, akan tetapi dapat digunakan untuk memecahkan permasalahan kecil yang memerlukan pemecahan lebih akurat.
Optik modernOptik modern meliputi bidang ilmu dan rekayasa optik yang menjadi terkenal pada abad ke 20. Bidang-bidang ilmu optik ini biasanya berhubungan dengan elektromagnetik atau sifat kuantum dari cahaya tetapi tidak termasuk topik lain.
Kaca adalah amorf (non kritalin) material padat yang bening dan transparan (tembus pandang), biasanya rapuh. Jenis yang paling banyak di gunakan selama berabad abad adalah jendela dan gelas minum.
Kaca dibuat dari campuran 75% silikon dioksida (SiO2) plus Na2O, CaO, dan beberapa zat tambahan.
Suhu lelehnya adalah 2.000 derajat Celsius.
Kaca juga memiliki beberapa arti:
- halaman buku (dalam beberapa bahasa daerah)
- cermin, benda yang dapat memantulkan cahaya / bentuk
- barang yang mudah pecah
Lup atau kaca pembesar adalah sebuah lensa cembung yang mempunyai titik fokus yang dekat dengan lensanya. Benda yang akan diperbesar terletak di dalam titik fokus lup itu atau jarak benda ke lensa lup tersebut lebih kecil dibandingkan jarak titik fokus lup ke lensa lup tersebut. Bayangan yang dihasilkan bersifat tegak, nyata, dan diperbesar. Lup ditemukan oleh seorang dari Arab bernama Abu Ali al-Hasan Ibn Al-Haitham.
Menghitung jarak titik fokus suatu Lup
Titik fokus suatu lup menentukan perbesaran yang dihasilkan, oleh karena itu titik fokusnya adalah besaran yang perlu diketahui (lihat juga dibawah). Dalam penggunaan sehari-hari jarak titik fokus dari sebuah lup dapat ditentukan dengan percobaan sederhana cahaya dapat dikumpulkan di satu titik yang berjarak tertentu dari lensa lup. Apabila cahaya mencapai tingkat energi yang tinggi maka kertas, serpih kayu, atau lainnya dapat terbakar ketika diletakkan di bawah lup tersebut. Dalam hal ini cahaya dikumpulkan di sebuah titik yang disebut titik fokus atau titik api yang sifatnya maya atau semu bukan nyata atau di belakang lensa tersebut.
Metode lain yang lebih nyata untuk menentukan jarak titik fokus atau disebut juga Autoklimasi dapat menggunakan:
- persamaan gambar Newtonschen (juga dapat diturunkan dari persamaan lensa)
- Metode Bessel
- Metode Abbe
Pembesaran
- V Pembesaran sudut
- ε0 Sudut pandang tanpa Lup
- ε Sudut pandang dengan Lup
- s0 jarak pandang normal
- O Besar objekt
- f Titik fokus