| Sebuah ringkasan singkat dari pembuatan etanol Etanol diproduksi dengan mereaksikan etena dengan uap. Reaksi ini reversibel, dan pembentukan etanol adalah eksotermik. Skema aliran untuk reaksi terlihat seperti ini: 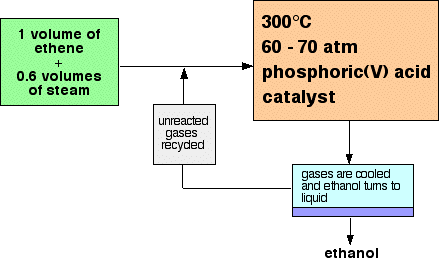 | |
Catatan: Ini adalah sedikit penyederhanaan! Ketika gas dari reaktor didinginkan, maka uap akan mengembun kelebihan serta etanol. Etanol akan harus dipisahkan dari air dengan distilasi fraksional. Semua sumber Saya telah melihat gloss selama ini, jadi saya tidak memiliki rincian. Aku menganggap itu adalah distilasi fraksional normal campuran etanol-air. | |
| Menjelaskan kondisi Proporsi etena dan uap Persamaan ini menunjukkan bahwa etena dan uap bereaksi 1: 1. Untuk mendapatkan rasio ini, Anda harus menggunakan volume yang sama dari dua gas. Hal ini sangat mengejutkan pada pandangan pertama. Bahkan jika reaksi itu satu arah, Anda tidak mungkin mengkonversi semua etena menjadi etanol. Tidak ada uap yang cukup untuk bereaksi dengan itu. Alasan untuk keanehan ini terletak pada sifat katalis. Katalis adalah fosfor (V) asam dilapisi ke dukungan silikon dioksida padat. Jika Anda menggunakan uap terlalu banyak, itu mencairkan katalis dan bahkan dapat mencucinya dukungan, sehingga tidak berguna. Suhu Equilibrium pertimbangan Anda perlu menggeser posisi kesetimbangan sejauh mungkin ke kanan untuk menghasilkan jumlah maksimum yang mungkin dari etanol dalam campuran kesetimbangan. Reaksi maju (produksi etanol) adalah eksotermik. Untuk mendapatkan etanol sebanyak mungkin dalam campuran kesetimbangan, Anda perlu serendah suhu mungkin. Namun, 300 ° C tidak terlalu rendah. Tingkat pertimbangan Suhu yang lebih rendah yang Anda gunakan, semakin lambat reaksi menjadi. Sebuah produsen berusaha untuk memproduksi etanol sebanyak mungkin per hari. Tidak masuk akal untuk mencoba untuk mencapai sebuah campuran kesetimbangan yang mengandung proporsi yang sangat tinggi etanol jika dibutuhkan beberapa tahun untuk reaksi untuk mencapai keseimbangan itu. Anda memerlukan gas untuk mencapai keseimbangan dalam waktu yang sangat singkat bahwa mereka akan kontak dengan katalis dalam reaktor. Kompromi 300 ° C adalah suhu kompromi menghasilkan proporsi diterima etanol dalam campuran kesetimbangan, tetapi dalam waktu yang sangat singkat. Dengan kondisi tersebut, sekitar 5% dari etena bereaksi untuk memberikan etanol pada setiap pass atas katalis. Tekanan Equilibrium pertimbangan Menurut Prinsip Le Chatelier, jika Anda meningkatkan tekanan sistem akan merespon dengan mendukung reaksi yang menghasilkan molekul yang lebih sedikit. Yang akan menyebabkan tekanan untuk jatuh lagi. Untuk mendapatkan etanol sebanyak mungkin dalam campuran kesetimbangan, Anda perlu setinggi tekanan mungkin. Tekanan tinggi juga meningkatkan laju reaksi. Namun, tekanan yang digunakan adalah tidak semua tinggi itu. Masalah dengan tekanan tinggi Ada dua masalah cukup terpisah dalam kasus ini:
| |
| Katalis Equilibrium pertimbangan Katalis tidak memiliki efek apapun pada posisi kesetimbangan. Menambahkan katalis tidak menghasilkan persentase lebih besar dari etanol dalam campuran kesetimbangan. Satunya fungsi adalah untuk mempercepat reaksi. Tingkat pertimbangan Dengan tidak adanya katalis reaksi sangat lambat sehingga hampir tidak ada reaksi terjadi dalam waktu yang masuk akal. Katalis memastikan bahwa reaksi yang cukup cepat untuk keseimbangan dinamis yang akan dibentuk dalam waktu yang sangat singkat bahwa gas benar-benar dalam reaktor. | |
Sabtu, 12 Mei 2012
Etanol diproduksi dengan mereaksikan etena dengan uap
Langganan:
Postingan (Atom)